コロナウイルスの構造と複製サイクル(ライフサイクル) 新型コロナのアカデミックなアプローチ
薬学部 額賀路嘉
新型コロナウイルスは世界中に感染を広めています。ニュースなどでは、コロナウイルスの電子顕微鏡図が良く出てきますが、実は写真の状態のウイルスは一切の生命活動をしていません。それでは、どのように増殖していくのでしょうか?そのライフサイクルはよく耳にする検査や予防、抗ウイルス薬と密接に関係しています。
1.ウイルス粒子の構造について
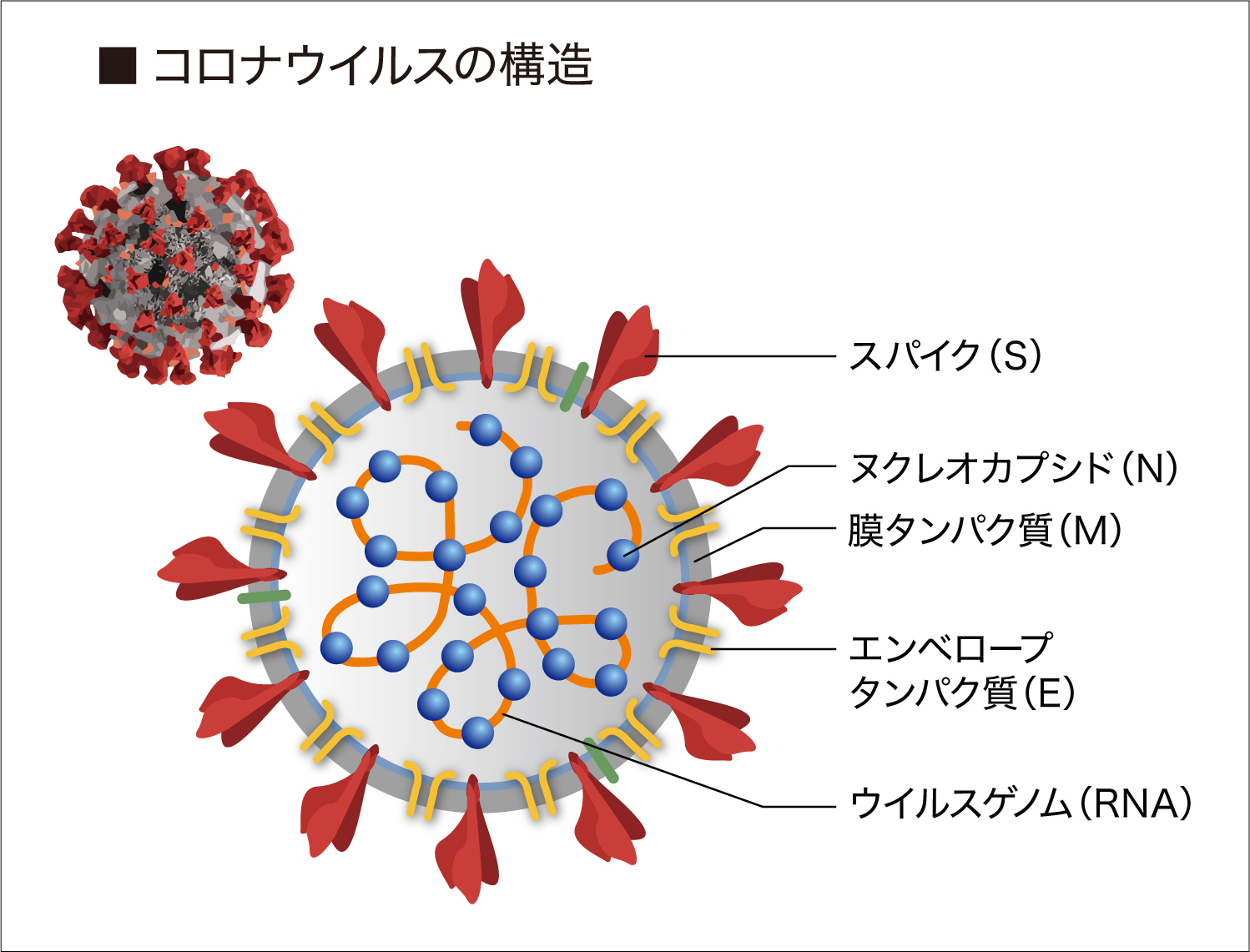
外観
新型コロナウイルス(SARS-CoV-2)は図のような、約100 nmの球形をしています。1mmの1/1000が1μmその1/10が100 nm、1 mmの1/10,000程度の大きさです。光学顕微鏡ではみることができず、観察には電子顕微鏡を使います。この大きさが、マスクを通す、通さないという議論になりマスクの有効性はあるのか?という話に繋がっています。1
表面の構造
ウイルス球体の周りにはエンベローブと呼ばれる脂質二重膜があり、この膜に突き刺さる形で、スパイクタンパク質が存在します。スパイクタンパク質は、ウイルス粒子の最も外側の構造ですから、感染するときに真っ先に相手に触れる構造です。また、ヒトの免疫系が抗体をつくるときにこのスパイクタンパク質を認識して、その形に合わせた抗体を作ることになります。外見的にも球形の外側を飾るような形、王冠の様だということでコロナという名前がついたということですから、スパイクタンパク質は、ウイルス粒子の顔のようなものです。
また、エンベロープという構造があることは、コロナウイルスに対してアルコール消毒が有効であることと関係しています。コロナウイルスやインフルエンザウイルスはエンベロープウイルスです。そのためエタノール(濃度70%-80%)の感受性が高く(良く効く)、エンベロープのないノロウイルス(ウイルス性胃腸炎の原因)等ではタンパク質の殻が一番外側であるため、アルコールが効きにくく、次亜塩素酸ナトリウム(0.05%程度)などが必要とされています。2
内部の構造
球体の内部には、約30 kb(3万塩基)からなるRNAゲノムがあり、カプシドというタンパク質と結合した状態で存在しています。全ての生物はゲノムにDNAを持っています。そしてRNAはDNAの情報を読み取りながら合成されます。一方、一般的にウイルスはDNAかRNAのどちらかのみをウイルス粒子の中にもち、ゲノムとします。コロナウイルスやインフルエンザウイルスはRNAをゲノムとして保持し、ヘルペスウイルス3などはDNAゲノムを持っています。
PCR検査というものを聞いたことがあると思います。ウイルスが体内にいるのかどうか確認するための検査です。高等学校の生物でも学習しますがPCRというのは特定のDNA位置に結合する2種のプライマーを使ってDNAの特定領域を大量に作り出す方法です。しかし、コロナウイルスはRNAしか持っていません。RNAにPCR法を適用するにはRT-PCR法を利用します。新型コロナウイルスのPCR検査は正確にはRT-PCR検査なのです。RT(Reverse Transcription)とは逆転写のことで、逆転写酵素がRNAを鋳型にDNAを合成することです。RTを行ってDNAを作ってから通常のPCR法を行うのがRT-PCR法です。本来、PCR検査というのは、検出感度は非常に高く、なにかの理由で、感染していないのに陽性判定と判断されることが問題になるくらいです。しかし、巷では検出精度が悪いなどといわれています。この逆転写のステップで一手間かかるということ、また、RNAはDNAに比べて、分解しやすく、扱いに注意が必要なことなどがPCR検査の信頼性ということに関係しているのかもしれません。
図や写真のウイルスの粒子はよく目にするもので、ウイルスのイメージそのものだと思いますが、その状態では生きているといえるものではありません。栄養も取らないし、呼吸もしない。粒子の中にはATPを作るための仕組みも一切ありません。このままでは増殖・分裂もしません。ただ、唯一持っているのは、宿主(感染先のことを言います)細胞に感染する能力をもっているということなのです。
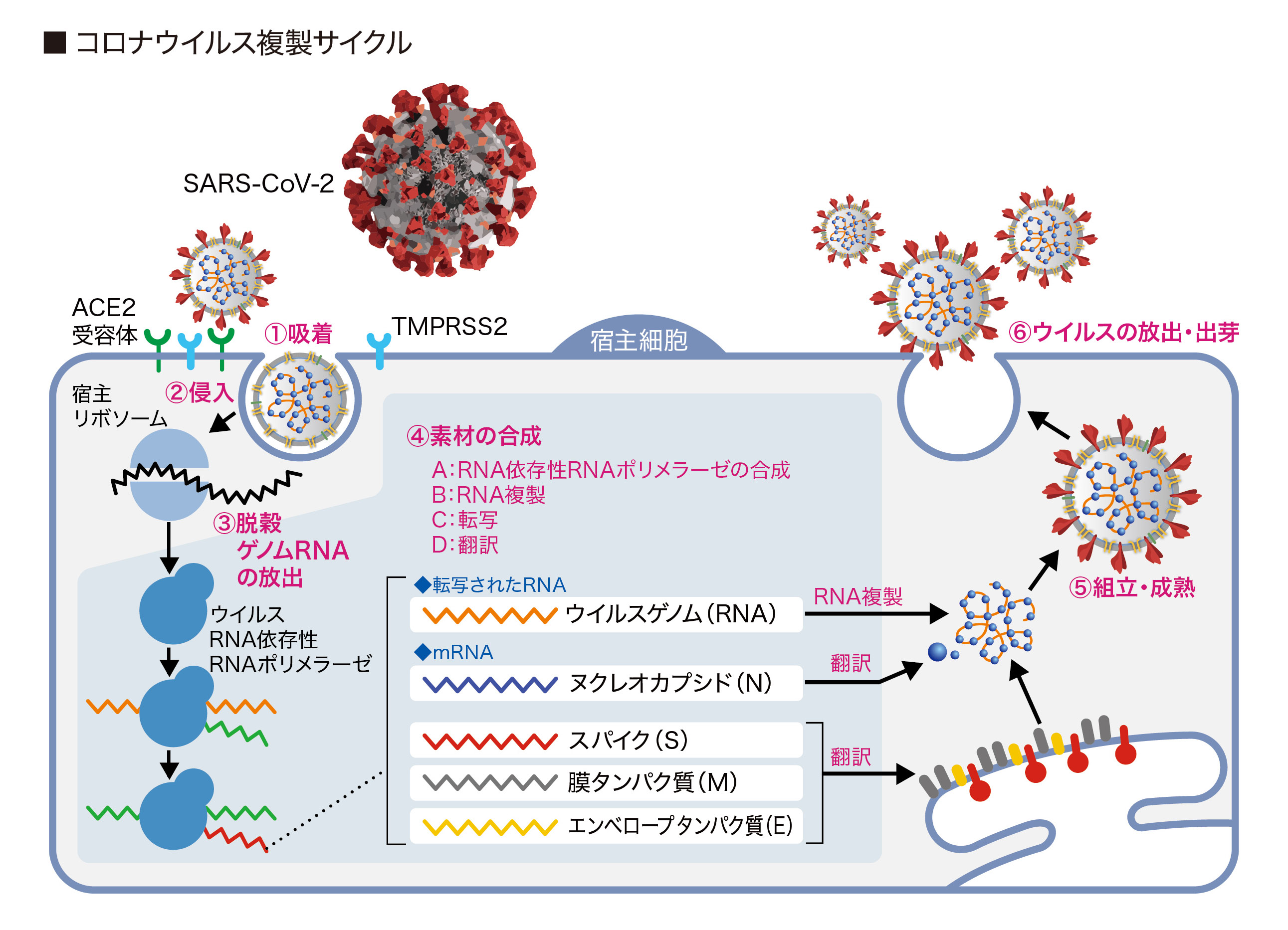
2.新型コロナウイルスの複製サイクル
ウイルスは、偏性細胞内寄生性があり、ウイルス粒子の状態では増殖できません。宿主(新型コロナウイルスではヒトの)細胞と呼ばれる寄生先が必要です。宿主細胞に侵入して、その細胞の機能を利用して自分を増やし、また、細胞から出て行きます。そのサイクルは図に示したように、7つの段階からなっています。
①吸着:ウイルスは、最初に、ヒトなど動物細胞表面の受容体に結合する必要があります。新型コロナウイルスでは、表面に突き出しているスパイクタンパク質が、細胞表面にある受容体、ACE2に結合することからこのライフサイクルは始まります。ACE2とは「アンジオテンシン変換酵素2」という細胞表面にある酵素タンパク質です。認識して結合する受容体はウイルスにより決まっていて、例えばインフルエンザウイルスでは上気道や下気道細胞表面のシアル酸糖鎖という構造が、HIVでは免疫細胞上のCD4というタンパク質がウイルス受容体として機能しています。ACE2はアンジオテンシンⅡと呼ばれる血圧調節するホルモン(正確にはオータコイド)の分解に関与しますが、感染により血圧が急激に変化することはないようです。また、最近の研究ではヒトが作るFurinと呼ばれるプロテアーゼ(タンパク質分解酵素)が切断する配列が(SARS-CoVにはなく)新型コロナウイルスのスパイクタンパク質に存在することがわかり、Furinによる切断によってACE2へより強く結合し、感染が拡大したのではないかと考えられています。
②侵入:スパイクタンパク質がACE2受容体と結合した後、細胞表面にあるTMPRSS2(II型膜貫通型セリンプロテアーゼ)という酵素がスパイクタンパク質の一部を切断すると、結合の様子が変わります。これをきっかけにしてウイルスのエンベロープと細胞膜との融合がはじまり、細胞内に侵入します4。膵炎の薬として使われているナファモスタットがTMPRSS2酵素がスパイクの一部を切断するステップを阻害することで、新型コロナウイルス薬として有望であると東京大学医科学研究所から発表がありました。
③ 脱殻:感染可能なウイルス粒子が分解されてなくなり、ゲノムRNAが露出して宿主細胞の細胞質に放出されるプロセスのことを言います。新型コロナウイルスの場合、②とほぼ同時に起こるようです。
④素材の合成:このプロセスは、ウイルスのゲノムから様々な核酸、タンパク質などのウイルス粒子の材料となる部品を作り出すことを言います。生物ではセントラルドグマと呼ばれる「DNA→RNA→タンパク質」という流れがあり、複製、転写、翻訳という過程で遺伝子の情報からタンパク質が作られていますが、コロナウイルスではゲノムがRNAのために少し複雑です。次の(ア)~(エ)のステップから成ります。
(ア) RNA依存性RNAポリメラーゼ(RdRp)の合成:(+)鎖のRNAをゲノムにもつコロナウイルスはまず最初に、ウイルスゲノムにコードされているRdRpを宿主のリボソームを利用してタンパク質合成(翻訳)します。RdRpは宿主の核内にあるDNA依存性RNAポリメラーゼとは異なり、ウイルスゲノムのRNA配列を読み取りながら新しいRNAを合成していく酵素タンパク質です。
(イ) ゲノムRNAの複製:(ア)のRdRpは(+)鎖5RNAゲノムから(ー)鎖RNAを合成し、さらに(ー)鎖を鋳型に(+)鎖ゲノムRNAを合成します。RdRpの阻害剤として、ファビピラビル(アビガン)やレムデシビルが期待され、治験が行われたり、認可されたりしています。これらは、もともとは、インフルエンザやエボラ出血熱の薬として開発されていたものです。これらの原因ウイルスはSARS-CoV-2と同様にRdRpをもつRNAウイルスです。
(ウ) 転写(mRNAの合成)と翻訳(タンパク質合成):ゲノムRNAだけでなく、より短い、サブゲノムmRNAを何種類か合成します。mRNA(伝令RNA)として機能し、ヒトのリボソームを介してウイルスタンパク質合成(翻訳)のために利用されます。
(エ) 通常、ヒトなどの細胞で1種類のタンパク質の情報は1本のmRNA上にのっていてそれを元にリボソームがタンパク質を合成します。しかし、コロナウイルスでは複数のタンパク質の情報がサブゲノムmRNA各々に同時にのっていて、1本の長いタンパク質の配列情報が連続して繋がっています。宿主細胞のリボソームはそれを一気に一本のアミノ酸の鎖(ポリペプチド鎖)として合成します。これをウイルス由来の「メインプロテアーゼ」6 と呼ばれる特定の配列を切断するプロテアーゼの作用で、必要な個々のタンパク質として切り出します。この仕組みはHIVやHCV(C型肝炎ウイルス)など、他のウイルスにも見られる特徴です。また、このプロテアーゼ阻害剤は、抗HIV薬や抗HCV薬として実用化されており、新型コロナウイルスにも期待されています。
⑤組立・成熟と⑥ ウイルス粒子の放出:さまざまなウイルス粒子を構成するパーツの中で、エンベロープに組み込まれるものは、粗面小胞体上でタンパク質合成され、小胞体膜上に組み込まれます。また、ウイルスゲノムRNAにカプシドタンパクが結合してヌクレオカプシドを形成し、これを囲むように、ウイルスタンパク質を含んだ小胞体膜が切り取られ、ウイルス粒子を形成、ゴルジ装置を介して、エキソサイトーシスで細胞外に放出されます。
以上の①から⑥の過程を経て、細胞内でウイルス量を数百倍にも増幅させてから細胞外へ放出した後、また周辺の未感染の細胞に吸着して感染を繰り返していきます。
3.おわりに
新型コロナウイルスに限らず、ウイルスは全て、単独では増殖することはできず、宿主細胞内でのみ増殖します。また、細菌などとは違い、細胞分裂で増えるわけではありません。活動中のウイルスを不活化する方法は、難しいと言えるでしょう。なぜなら、活動しているウイルスはその大部分を宿主であるヒトのシステムを使っているからです。それを、破壊しようとすれば、ヒトのシステムまで破壊してしまいます。ウイルスのみの有効な手段は多くはありません。目的のものだけに効果をもたせる性質を選択毒性といいます。抗ウイルス薬には副作用の問題がついてまわり、選択毒性の高い医薬品を開発することが難しいのです。しかし、ウイルスのライフサイクル①から⑥の中には、選択毒性の高い抗ウイルス薬の作用点候補として、いくつか有望な標的(ターゲット)タンパク質も含まれています。例えば、「RNA依存性RNAポリメラーゼ」は、ヒトのシステムにはないものでターゲットとして有望です。また、侵入に関係するTMPRSS2の阻害剤などは既に使われているフサン(ナファモスタット)という医薬品があり、新型コロナウイルス薬として期待されています。また、プロテアーゼ阻害剤は、HIVやHCVでは実用化されています。今後の、研究の進展に期待しています。
薬学部 機能生理化学研究室 教授 額賀 路嘉 (ぬかが みちよし)
担当科目:
薬学基礎生物、生理化学I、生理化学II、生物系演習、病院機能特論演習、教員免許状更新講習講師
問題
細菌とウイルスの違いは、感染症を考える上で大変重要な概念です。是非整理してみましょう。
検査、マスクなどで言われる問題点は、ウイルスのどのような性質が関係しているでしょうか?考えてみましょう。
ファビピラビルやレムデシビルのターゲットは何なのかウイルスの複製サイクルと合わせて理解しましょう。
関連する科目
薬学基礎生物、微生物学I、微生物学II、分子生物学、病院機能特論、生物系実習
脚注
- 日本では検定企画はないそうですが、環境省HP内のマスク工業会の資料によると、BFE(約3?、バクテリアろ過)、VFE(約1.7?、ウイルス飛沫ろ過)の試験、PFE(ラテックス微粒子ろ過率0.1umラテックス)などでフィルタ捕集効果を確認しているとのことです。ウイルス単体は通してしまいますが、飛沫(5μm以上)には十分効果が期待できます。花粉は、約30μmと大きく、花粉用マスクは別ですのでご注意をお願いします。
- エタノールと次亜塩素酸ナトリウムは濃度も用途も異なります。特に次亜塩素酸ナトリウムは家庭用漂白剤にも使われている成分で、手指消毒には向きません。
- 口唇ヘルペスや水ぼうそう、帯状疱疹の原因ウイルスです。
- TMPRSS2の代わりにカテプシンという別のプロテアーゼが働く場合もある様です。
- (+)鎖というのは、コドンの配列をもち、そのままリボソームを使って翻訳されることが可能な鎖のことです。(−)鎖は、その相補的な配列を持ちます。
- コロナウイルスゲノムには複数のプロテアーゼ遺伝子が含まれ、一本の長いタンパク質から個々の役割を担うタンパク質へ切り出しする機能をもつプロテアーゼをメインプロテアーゼと呼んでいます。